EL ÁTOMO
Es un constituyente de la materia ordinaria, con propiedades químicas bien definidas, formado a su vez por constituyentes más elementales sin propiedades químicas bien definidas. Cada elemento químico está formado por átomos del mismo tipo (con la misma estructura electrónica básica), y que no es posible dividir mediante procesos químicos.

MODELOS ATÓMICOS
EL MODELO ATÓMICO DE JOHN DALTON
El modelo atómico de Dalton surgido en el contexto de la química, fue el primer modelo atómico con bases científicas, formulado entre 1803 y 1807 por John Dalton.
El modelo permitió aclarar por primera vez por qué las sustancias químicas reaccionaban en proporciones estequiométricas fijas (Ley de las proporciones constantes), y por qué cuando dos sustancias reaccionan para formar dos o más compuestos diferentes, entonces las proporciones de estas relaciones son números enteros (Ley de las proporciones múltiples). Por ejemplo 12 g de carbono (C), pueden reaccionar con 16 g de oxígeno (O2) para formar monóxido de carbono (CO) o pueden reaccionar con 32 g de oxígeno para formar dióxido de carbono (CO2). Además el modelo aclaraba que aún existiendo una gran variedad de sustancias diferentes, estas podían ser explicadas en términos de una cantidad más bien pequeña de constituyentes elementales o elementos. En esencia, el modelo explicaba la mayor parte de la química de fines del siglo XVIII y principios del siglo XIX, reduciendo una serie de hechos complejos a una teoría combinatoria realmente simple.
Postulados de Dalton
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen el mismo peso e iguales propiedades. Los átomos de diferentes elementos tienen peso diferente. Comparando el peso de los elementos con los del hidrógeno tomado como la unidad propuso el concepto de peso atómico relativo.
- Los átomos permanecen sin división, aun cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.

La materia está formada por partículas muy pequeñas llamadas “átomos”. Estos átomos no se pueden dividir ni romper, no se crean ni se destruyen en ninguna reacción química, y nunca cambian.
Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa y dimensiones. Por ejemplo: todos los átomos de hidrógeno son iguales.
Por otro lado, los átomos de elementos diferentes son diferentes. Por ejemplo: los átomos de oxígeno son diferentes a los átomos de hidrógeno.
Los átomos pueden combinarse para formar compuestos químicos. Por ejemplo: los átomos de hidrógeno y oxígeno pueden combinarse y formar moléculas de agua.
Los átomos se combinan para formar compuestos en relaciones numéricas simples. Por ejemplo: al formarse agua, la relación es de 2 a 1 (dos átomos de hidrógeno con un átomo de oxígeno).
Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto. Por ejemplo: un átomo de carbono con uno de oxígeno forman monóxido de carbono (CO), mientras que dos átomos de oxígeno con uno de carbono, forman dióxido de carbono (CO2).
Insuficiencia del modelo
La hipótesis de John Dalton, que afirmaba que los elementos en estado gaseoso eran monoatómicos y que los átomos de los elementos se combinaban en la menor proporción posible para formar átomos de los compuestos, lo que hoy llamamos moléculas, generó algunas dificultades. Por ejemplo, Dalton pensó que la fórmula del agua era HO. En consecuencia de esto se realizaron cálculos erróneos sobre la masa y peso de algunos compuestos básicos.
En 1805, Gay-Lussac y Alexander von Humboldt mostraron que el agua estaba formada por dos hidrógenos y un oxígeno. En 1811, Amedeo Avogadro concretó la exacta composición del agua, basándose en lo que hoy se conoce como Ley de Avogadro y la evidencia de la existencia de moléculas diatómicashomonucleares. No obstante, estos resultados fueron ignorados en su mayor parte hasta 1860. Esto fue, en parte, por la creencia de que los átomos de un elemento no tenían ninguna afinidad química hacia átomos del mismo elemento. Además, algunos conceptos de la disociación de moléculas no estaban explicados en la Ley de Avogadro.
En 1860, en el Congreso de Karlsruhe sobre masas estables y pesos atómicos, Cannizzaro revivió las ideas de Avogadro y las usó para realizar una tabla periódica de pesos atómicos, que tenían bastante similitud con los actuales valores. Estos pesos fueron un importante requisito para el descubrimiento de la Tabla periódica de Dmitri Mendeléyev y Lothar Meyer.
Hasta la segunda mitad del siglo XIX no aparecieron evidencias de que los átomos fueran divisibles o estuvieran a su vez constituidos por partes más elementales. Por esa razón el modelo de Dalton no fue cuestionado durante décadas, ya que explicaba adecuadamente los hechos. Si bien el modelo usualmente nacido para explicar los compuestos químicos y las regularidades estequiométricas, no podía explicar las regularidades periódicas en las propiedades de los elementos químicos tal como aparecieron en la tabla periódica de los elementos de Mendeleiev (esto sólo sería explicado por los modelos que suponían el átomo estaba formado por electrones dispuestos en capas). El modelo de Dalton tampoco podía dar cuenta de las investigaciones realizadas sobre rayos catódicos que sugirieron que los átomos no eran indivisibles sino que contenían partículas más pequeñas cargadas eléctricamente.
EL MODELO ATÓMICO DE THOMSON
 El modelo atómico de Thomson es una teoría sobre la estructura atómica propuesta en 1904 por Joseph John Thomson, quien descubrió el electrón1 en 1897, mucho antes del descubrimiento del protón y del neutrón. En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, embebidos en éste al igual que las pasas de un budín. A partir de esta comparación, fue que el supuesto se denominó "Modelo del budín de pasas".2 3 Postulaba que los electrones se distribuían uniformemente en el interior del átomo suspendidos en una nube de carga positiva. El átomo se consideraba como una esfera con carga positiva con electrones repartidos como pequeños gránulos. La herramienta principal con la que contó Thomson para su modelo atómico fue la electricidad.
El modelo atómico de Thomson es una teoría sobre la estructura atómica propuesta en 1904 por Joseph John Thomson, quien descubrió el electrón1 en 1897, mucho antes del descubrimiento del protón y del neutrón. En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, embebidos en éste al igual que las pasas de un budín. A partir de esta comparación, fue que el supuesto se denominó "Modelo del budín de pasas".2 3 Postulaba que los electrones se distribuían uniformemente en el interior del átomo suspendidos en una nube de carga positiva. El átomo se consideraba como una esfera con carga positiva con electrones repartidos como pequeños gránulos. La herramienta principal con la que contó Thomson para su modelo atómico fue la electricidad.Éxitos del modelo
El nuevo modelo atómico usó la amplia evidencia obtenida gracias al estudio de los rayos catódicos a lo largo de la segunda mitad del siglo XIX. Si bien el modelo atómico de Dalton daba debida cuenta de la formación de los procesos químicos, postulando átomos indivisibles, la evidencia adicional suministrada por los rayos catódicos sugería que esos átomos contenían partículas eléctricas de carga negativa. El modelo de Dalton ignoraba la estructura interna, pero el modelo de Thomson aunaba las virtudes del modelo de Dalton y simultáneamente podía explicar los hechos de los rayos catódicos.
Insuficiencia del modelo
Si bien el modelo de Thomson explicaba adecuadamente muchos de los hechos observados de la química y los rayos catódicos, hacía predicciones incorrectas sobre la distribución de la carga positiva en el interior de los átomos. Las predicciones del modelo de Thomson resultaban incompatibles con los resultados del experimento de Rutherford,que sugería que la carga positiva estaba concentrada en una pequeña región en el centro del átomo, que es lo que se conoció como núcleo atómico. El modelo atómico de Rutherford, permitió explicar esto último, revelando la existencia de un núcleo atómico cargado positivamente y de elevada densidad. Otro hecho que el modelo de Thomson había dejado por explicar era la regularidad de la tabla periódica de Mendeleiev. Los modelos de Bohr, Sommerfeld y Schrödinger finalmente explicarían las regularidades periódicas en las propiedades de los elementos químicos de la tabla, como resultado de una disposición más estructurada de los electrones en el átomo, que ni el modelo de Thomson ni el modelo de Rutherford habían considerado.
MODELO ATÓMICO DE RUTHERFORD

El modelo atómico de Rutherford es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford para explicar los resultados de su "experimento de la lámina de oro", realizado en 1911.
El modelo de Rutherford fue el primer modelo atómico que consideró al átomo formado por dos partes: la "corteza" (luego denominada periferia), constituida por todos sus electrones, girando a gran velocidad alrededor de un "núcleo" muy pequeño; que concentra toda la carga eléctrica positiva y casi toda la masa del átomo.
Rutherford llegó a la conclusión de que la masa del átomo se concentraba en una región pequeña de cargas positivas que impedían el paso de las partículas alfa. Sugirió un nuevo modelo en el cual el átomo poseía un núcleo o centro en el cual se concentra la masa y la carga positiva, y que en la zona extra nuclear se encuentran los electrones de carga negativa.
Historia
Antes de que Rutherford propusiera su modelo atómico, los físicos aceptaban que las cargas eléctricas en el átomo tenían una distribución más o menos uniforme. Rutherford trató de ver cómo era la dispersión de las partículas alfa por parte de los átomos de una lámina de oro muy delgada. Los ángulos resultantes de la desviación de las partículas supuestamente aportarían información sobre cómo era la distribución de carga en los átomos. Era de esperar que, si las cargas estaban distribuidas uniformemente según el modelo atómico de Thomson, la mayoría de las partículas atravesarían la delgada lámina sufriendo sólo ligerísimas deflexiones, siguiendo una trayectoria aproximadamente recta. Aunque esto era cierto para la mayoría de las partículas alfa, un número importante de estas sufrían deflexiones de cerca de 180º, es decir, prácticamente salían rebotadas en dirección opuesta a la incidente.
Rutherford pensó que esta fracción de partículas rebotadas en dirección opuesta podía ser explicada si se suponía la existencia de fuertes concentraciones de carga positiva en el átomo. La mecánica newtoniana en conjunción con la ley de Coulomb predice que el ángulo de deflexión de una partícula alfa relativamente liviana por parte de un átomo de oro más pesado, depende del "parámetro de impacto" o distancia entre la trayectoria de la partícula y el núcleo:1
(1)
Donde:
 , siendo
, siendo 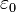 la constante dieléctrica del vacío y
la constante dieléctrica del vacío y  la carga eléctrica del centro dispersor.
la carga eléctrica del centro dispersor. , es la energía cinética inicial de la partícula alfa incidente.
, es la energía cinética inicial de la partícula alfa incidente.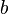 es el parámetro de impacto.
es el parámetro de impacto.
Dado que Rutherford observó una fracción apreciable de partículas "rebotadas" para las cuales el ángulo de deflexión es cercano a χ ≈ π, de la relación inversa a ():
(2)
se deduce que el parámetro de impacto debe ser bastante menor que el radio atómico. De hecho el parámetro de impacto necesario para obtener una fracción apreciable de partículas "rebotadas" sirvió para hacer una estimación del tamaño del núcleo atómico, que resulta ser unas cien mil veces más pequeño que el diámetro atómico. Este hecho resultó ser la capacidad uniformable sobre la carga positiva de neutrones.
Importancias del modelo y limitaciones
La importancia del modelo de Rutherford residió en proponer por primera vez la existencia de un núcleo en el átomo (término que, paradójicamente, no aparece en sus escritos). Lo que Rutherford consideró esencial, para explicar los resultados experimentales, fue "una concentración de carga" en el centro del átomo, ya que sin ella, no podía explicarse que algunas partículas fueran rebotadas en dirección casi opuesta a la incidente. Este fue un paso crucial en la comprensión de la materia, ya que implicaba la existencia de un núcleo atómico donde se concentraba toda la carga positiva y más del 99,9% de la masa. Las estimaciones del núcleo revelaban que el átomo en su mayor parte estaba vacío.
Rutherford propuso que los electrones orbitarían en ese espacio vacío alrededor de un minúsculo núcleo atómico, situado en el centro del átomo. Además se abrían varios problemas nuevos que llevarían al descubrimiento de nuevos hechos y teorías al tratar de explicarlos:
Por un lado se planteó el problema de cómo un conjunto de cargas positivas podían mantenerse unidas en un volumen tan pequeño, hecho que llevó posteriormente a la postulación y descubrimiento de la fuerza nuclear fuerte, que es una de las cuatro interacciones fundamentales.
Por otro lado existía otra dificultad proveniente de la electrodinámica clásica que predice que una partícula cargada y acelerada, como sería el caso de los electrones orbitando alrededor del núcleo, produciría radiación electromagnética, perdiendo energía y finalmente cayendo sobre el núcleo. Las leyes de Newton, junto con las ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de 10^{-10}s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo.2 Se trata, por tanto de un modelo físicamente inestable, desde el punto de vista de la física clásica.
Según Rutherford, las órbitas de los electrones no están muy bien definidas y forman una estructura compleja alrededor del núcleo, dándole un tamaño y forma algo indefinidas. Los resultados de su experimento le permitieron calcular que el radio atómico era diez mil veces mayor que el núcleo mismo, y en consecuencia, que el interior de un átomo está prácticamente vacío.
MODELO ATÓMICO DE BORH
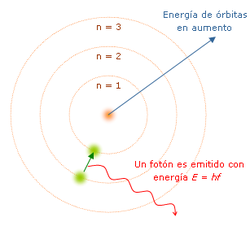 El modelo atómico de Bohr o de Bohr-Rutherford es un modelo clásico del átomo, pero fue el primer modelo atómico en el que se introduce una cuantización a partir de ciertos postulados. Fue propuesto en 1913 por el físico danés Niels Bohr, para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos (dos problemas que eran ignorados en el modelo previo de Rutherford). Además el modelo de Bohr incorporaba ideas tomadas del efecto fotoeléctrico, explicado por Albert Einstein en 1905.
El modelo atómico de Bohr o de Bohr-Rutherford es un modelo clásico del átomo, pero fue el primer modelo atómico en el que se introduce una cuantización a partir de ciertos postulados. Fue propuesto en 1913 por el físico danés Niels Bohr, para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos (dos problemas que eran ignorados en el modelo previo de Rutherford). Además el modelo de Bohr incorporaba ideas tomadas del efecto fotoeléctrico, explicado por Albert Einstein en 1905.Biografía de Niels Bohr
Físico danés, que hizo aportaciones fundamentales en el campo de la física nuclear y en el de la estructura atómica. Era hijo de un profesor de fisiología y estudió en la universidad de su ciudad natal, donde alcanzó el doctorado en 1911. Ese mismo año fue a la Universidad de Cambridge (Inglaterra) para estudiar física nuclear con J.J. Thomson, pero pronto se trasladó a la Universidad de Manchester para trabajar con Ernest Rutherford.
La teoría de la estructura atómica de Bohr, que le valió el Premio Nobel de Física en 1922, se publicó en una memoria entre 1913 y 1915. Su trabajo giró sobre el modelo nuclear del átomo de Rutherford, en el que el átomo se ve como un núcleo compacto rodeado por un enjambre de electrones más ligeros. El modelo de átomo de Bohr utilizó la teoría cuántica y la constante de Planck. El modelo de Bohr establece que un átomo emite radiación electromagnética sólo cuando un electrón del átomo salta de un nivel cuántico a otro. Este modelo contribuyó enormemente al desarrollo de la física atómica teórica.
En 1916, Bohr regresó a la Universidad de Copenhague como profesor de física, y en 1920 fue nombrado director del Instituto de Física Teórica de esa universidad, recién constituido. Allí, Bohr elaboró una teoría que relaciona los números cuánticos de los átomos con los grandes sistemas que siguen las leyes clásicas, y realizó otras importantes aportaciones a la física teórica. Su trabajo ayudó a impulsar el concepto de que los electrones se encuentran en capas y que los de la última capa determinan las propiedades químicas de un átomo.

En 1939, reconociendo el significado de los experimentos de la fisión de los científicos alemanes Otto Hahn y Fritz Strassmann, Bohr convenció a los físicos en una conferencia en Estados Unidos de la importancia de estos experimentos. Más tarde, demostró que el uranio 235 es el isótopo del uranio que experimenta la fisión nuclear. Bohr regresó posteriormente a Dinamarca, donde fue obligado a permanecer después de la ocupación alemana del país en 1940. Sin embargo, consiguió llegar a Suecia con gran peligro de su vida y de la de su familia. Desde Suecia, la familia Bohr viajó a Inglaterra y por último a los Estados Unidos, donde Bohr se incorporó al equipo que trabajaba en la construcción de la primera bomba atómica en Los Álamos (Nuevo México), hasta su explosión en 1945. Bohr se opuso, sin embargo, a que el proyecto se llevara a cabo en total secreto, y temía las consecuencias de este siniestro nuevo invento. Deseaba un control internacional.
En 1945, Bohr regresó a la Universidad de Copenhague donde, inmediatamente, comenzó a desarrollar usos pacifistas para la energía atómica. Organizó la primera conferencia "Átomos para la paz" en Ginebra, celebrada en 1955, y dos años más tarde recibió el primer premio "Átomos para la paz". Bohr murió el 18 de diciembre de 1962 en Copenhague.
Introducción
Bohr se basó en el átomo de hidrógeno para hacer el modelo que lleva su nombre. Bohr intentaba realizar un modelo atómico capaz de explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que se observan en los gases. Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. El modelo atómico de Bohr partía conceptualmente del modelo atómico de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein.
En este modelo los electrones giran en órbitas circulares alrededor del núcleo, ocupando la órbita de menor energía posible, o la órbita más cercana posible al núcleo. El electromagnetismo clásico predecía que una partícula cargada moviéndose de forma circular emitiría energía por lo que los electrones deberían colapsar sobre el núcleo en breves instantes de tiempo. Para superar este problema Bohr supuso que los electrones solamente se podían mover en órbitas específicas, cada una de las cuales caracterizada por su nivel energético. Cada órbita puede entonces identificarse mediante un número entero n que toma valores desde 1 en adelante. Este número "n" recibe el nombre de número cuántico principal.
Bohr supuso además que el momento angular de cada electrón estaba cuantizado y sólo podía variar en fracciones enteras de la constante de Planck. De acuerdo al número cuántico principal calculó las distancias a las cuales se hallaba del núcleo cada una de las órbitas permitidas en el átomo de hidrógeno. Estos niveles en un principio estaban clasificados por letras que empezaban en la "K" y terminaban en la "Q". Posteriormente los niveles electrónicos se ordenaron por números. Cada órbita tiene electrones con distintos niveles de energía obtenida que después se tiene que liberar y por esa razón el electrón va saltando de una órbita a otra hasta llegar a una que tenga el espacio y nivel adecuado, dependiendo de la energía que posea, para liberarse sin problema y de nuevo volver a su órbita de origen. Sin embargo no explicaba el espectro de estructura fina que podría ser explicado algunos años más tarde gracias al modelo atómico de Sommerfeld. Históricamente el desarrollo del modelo atómico de Bohr junto con la dualidad onda-corpúsculo permitiría a Erwin Schrödinger descubrir la ecuación fundamental de la mecánica cuántica.
Postulados de Borh
En 1913, Niels Bohr desarrolló su célebre modelo atómico de acuerdo a tres postulados fundamentales:1
Primer postulado
Los electrones describen órbitas circulares en torno al núcleo del átomo sin irradiar energía.
La causa de que el electrón no irradie energía en su órbita es, de momento, un postulado, ya que según la electrodinámica clásica una carga con un movimiento acelerado debe emitir energía en forma deradiación.
Para mantener la órbita circular, la fuerza que siente el electrón —la fuerza coulombiana por la presencia del núcleo— debe ser igual a la fuerza centrípeta. Esto nos da la siguiente expresión:
- Donde el primer término es la fuerza eléctrica o de Coulomb, y el segundo es la fuerza centrífuga; k es la constante de la fuerza de Coulomb, Z es el número atómico del átomo, e es la carga del electrón,
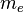 es la masa del electrón, v es la velocidad del electrón en la órbita y r el radio de la órbita.
es la masa del electrón, v es la velocidad del electrón en la órbita y r el radio de la órbita.
En la expresión anterior podemos despejar el radio, obteniendo:
Y ahora, con esta ecuación, y sabiendo que la energía total es la suma de las energías cinética y potencial:
- Donde queda expresada la energía de una órbita circular para el electrón en función del radio de dicha órbita.
Segundo postulado
 No toda órbita para electrón está permitida, tan solo se puede encontrar en órbitas cuyo radio cumpla que el momento angular,
No toda órbita para electrón está permitida, tan solo se puede encontrar en órbitas cuyo radio cumpla que el momento angular,  , del electrón sea un múltiplo entero de
, del electrón sea un múltiplo entero de 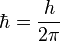 Esta condición matemáticamente se escribe:
Esta condición matemáticamente se escribe:- con
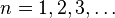
A partir de ésta condición y de la expresión para el radio obtenida antes, podemos eliminar  y queda la condición de cuantización para los radios permitidos:
y queda la condición de cuantización para los radios permitidos:
 y queda la condición de cuantización para los radios permitidos:
y queda la condición de cuantización para los radios permitidos:- con
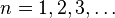 ; subíndice introducido en esta expresión para resaltar que el radio ahora es una magnitud discreta, a diferencia de lo que decía el primer postulado.
; subíndice introducido en esta expresión para resaltar que el radio ahora es una magnitud discreta, a diferencia de lo que decía el primer postulado.
Ahora, dándole valores a  , número cuántico principal, obtenemos los radios de las órbitas permitidas. Al primero de ellos (con n=1), se le llama radio de Bohr:
, número cuántico principal, obtenemos los radios de las órbitas permitidas. Al primero de ellos (con n=1), se le llama radio de Bohr:
 , número cuántico principal, obtenemos los radios de las órbitas permitidas. Al primero de ellos (con n=1), se le llama radio de Bohr:
, número cuántico principal, obtenemos los radios de las órbitas permitidas. Al primero de ellos (con n=1), se le llama radio de Bohr:- expresando el resultado en ångström.
Del mismo modo podemos ahora sustituir los radios permitidos 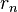 en la expresión para la energía de la órbita y obtener así la energía correspondiente a cada nivel permitido:
en la expresión para la energía de la órbita y obtener así la energía correspondiente a cada nivel permitido:
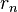 en la expresión para la energía de la órbita y obtener así la energía correspondiente a cada nivel permitido:
en la expresión para la energía de la órbita y obtener así la energía correspondiente a cada nivel permitido:
Igual que antes, para el átomo de hidrógeno (Z=1) y el primer nivel permitido (n=1), obtenemos:
- que es la llamada energía del estado fundamental del átomo de Hidrógeno.
Y podemos expresar el resto de energías para cualquier Z y n como:
El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra. En dicho cambio emite o absorbe un fotón cuya energía es la diferencia de energía entre ambos niveles. Este fotón, según la ley de Planck tiene una energía:Tercer postulado
- donde
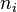 identifica la órbita inicial y
identifica la órbita inicial y 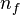 la final, y
la final, y 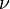 es la frecuencia.
es la frecuencia.
Entonces las frecuencias de los fotones emitidos o absorbidos en la transición serán:
A veces, en vez de la frecuencia se suele dar la inversa de la longitud de onda:
Esta última expresión fue muy bien recibida porque explicaba teóricamente la fórmula fenomenológica hallada antes por Balmer para describir las líneas espectrales observadas desde finales del siglo XIX en la desexcitación del Hidrógeno, que venían dadas por:
- con
 , y donde
, y donde 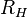 es la constante de Rydberg para el hidrógeno. Y como vemos, la expresión teórica para el caso
es la constante de Rydberg para el hidrógeno. Y como vemos, la expresión teórica para el caso  , es la expresión predicha por Balmer, y el valor medido experimentalmente de la constante de Rydberg (
, es la expresión predicha por Balmer, y el valor medido experimentalmente de la constante de Rydberg ( ), coincide con el valor de la fórmula teórica.
), coincide con el valor de la fórmula teórica.
Se puede demostrar que este conjunto de hipótesis corresponde a la hipótesis de que los electrones estables orbitando un átomo están descritos por funciones de onda estacionarias. Un modelo atómico es una representación que describe las partes que tiene un átomo y como están dispuestas para formar un todo. Basándose en la constante de Planck 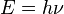 consiguió cuantizar las órbitas observando las líneas del espectro.
consiguió cuantizar las órbitas observando las líneas del espectro.
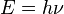 consiguió cuantizar las órbitas observando las líneas del espectro.
consiguió cuantizar las órbitas observando las líneas del espectro.
TEORÍA CUÁNTICA
El modelo actual del átomo se basa en la mecánica cuántica ondulatoria, la cual está fundamentada en cuatro números cuánticos, mediante los cuales puede describirse un electrón en un átomo.
El desarrollo de está teoría durante la década de 1920 es el resultado de las contribuciones de destacados científicos entre ellos Einstein, Planck (1858-1947), de Broglie, Bohr (1885-1962), Schrödinger (1887-1961) y Heisenberg..
La siguiente figura muestra las modificaciones que ha sufrido el modelo del átomo desde Dalton hasta Schrödinger.
NÚMEROS CUÁNTICOS
1) NÚMERO CUÁNTICO PRINCIPAL (n)
Representa los niveles energéticos. Se designa con números enteros positivos desde n=1 hasta n=7 para los elementos conocidos.Para calcular el número máximo de electrones que acepta cada nivel se calcula con la fórmula 2n
El valor de "n" determina el volumen efectivo.
Ejms:
| NIVEL ( n ) | Número máximo de electrones |
1
|
2 ( 1 )
|
2
|
2 ( 2 )
|
3
|
2 ( 3 )
|
4
|
2 ( 4 )
|

2) NÚMERO CUÁNTICO SECUNDARIO O AZIMUTAL ( l )
Determina el subnivel y se relaciona con la forma del orbital.Cada nivel energético ( n ) tiene "n" subniveles.
Ejms.
| NIVEL ENERGÉTICO ( n ) |
Número de subniveles contenidos en el nivel
|
1
|
1
|
2
|
2
|
3
|
3
|
Se designa con números que van de cero a n-1, los cuales se identifican con las letras s, p, d, f.
NIVEL
|
SUBNIVEL
(número asignado)
|
LETRA
|
1
|
l = 0
|
s
|
2
|
l = 0
l = 1 |
s
p |
3
|
l = 0
l = 1 l = 2 |
s
p d |
A continuación se muestra la forma de los 4 subniveles: s, p, d, f

Cada subnivel acepta un número máximo de electrones:
s = 2 e-
p = 6 e-
d = 10 e-
f = 14 e-
p = 6 e-
d = 10 e-
f = 14 e-
3) NÚMERO CUÁNTICO MAGNÉTICO (m)
Representa los orbitales presentes en un subnivel.
Se designa con números que van de -l a + l pasando por cero.
n
|
l
|
m
|
1
|
0 ( s )
|
0
|
2
|
0 ( s )
1 ( p ) |
0
-1, 0, +1 |
3
|
0 ( s )
1 ( p ) 2 ( d ) |
0
-1, 0, +1 -2, -1, 0, +1, +2 |
Cada orbital acepta un máximo de 2 electrones.
4) NÚMERO CUÁNTICO POR SPIN (s)
Se relaciona con el giro del electrón sobre su propio eje. Al estar juntos en un mismo orbital, un electrón gira hacia la derecha y otro hacia la izquierda. Se le asignan números fraccionarios: -1/2 y +1/2
EJERCICIO DE NÚMEROS CUÁNTICOS:
Señala con una "X" el número incorrecto de las series mostradas a continuación, dando una breve explicación justificando su respuesta. El primer renglón está resuelto como ejemplo señalando con rojo el número incorrecto.
n
|
l
|
s
|
m
|
Explicación
|
5
|
5
|
-2
|
+1/2
|
En n = 5 l = 0,1,2,3 y 4
|
0
|
1
|
0
|
-1/2
| |
4
|
2
|
-3
|
+1/2
| |
1
|
0
|
0
|
0
| |
-2
|
1
|
-1
|
+1/2
| |
3
|
1
|
+2
|
-1/2
| |
6
|
-2
|
0
|
+1/2
| |
3
|
2
|
-1
|
+1/3
| |
2
|
3
|
-1
|
-1/2
| |
6
|
5
|
-5
|
3
| |
4
|
2
|
+3
|
-1/2
|
CONFIGURACIÓN ELECTRÓNICA.-
Muestra el acomodo de los electrones en el átomo en niveles y subniveles.
La configuración electrónica puede mostrarse en dos formas:
La configuración electrónica puede mostrarse en dos formas:
a) Condensada
b) Desarrollada
b) Desarrollada
a) CONDENSADA.- Solo muestra el nivel, el subnivel y el número de electrones.
Ejem:
Ejem:
Establece que: " Los electrones van formando los orbitales atómicos de menor a mayor contenido de energía."
Cada uno de los subniveles con su respectivo nivel principal de energía, tiene diferente energía. Los subniveles están ordenados de acuerdo co su incremento de energía en la siguiente lista (el símbolo < se lee "menor que".)
1s < 2s < 2p < 3s < 3p < 4s < 3d <4p < 5s < 4d < 5s < 4d < 5p < 6s < 4f < 5d...
A continuación se muestra un diagrama que representa las energías relativas de los diferentes subniveles electrónicos. Los números entre paréntesis significan la cantidad máxima de electrones en el subnivel. Los subniveles "s" se muestran en negro, los subnivel "p" en rojo, los subniveles "d" en azul y los "f" en verde.

A continuación se muestra una diagrama fácil de elaborar, que nos ayuda a recordar la forma en los que niveles y subniveles del átomo se van llenando.


Ejemplos de configuraciones electrónicas condensadas
Número de masa (# de p+ + # de no)
17Cl: 1s
Número atómico (Representa el # de p+, y como el átomo es neutro # p+ = #e-)
30Zn: 1s
A partir de la configuración electrónica condensada, nosotros podemos obtener los siguientes datos:
a) Nivel de energía más externo: Es el último nivel, por tanto está representado por el coeficiente más alto.
b) Último subnivel que se forma: Es el subnivel en el cual termina la configuración.
c) Electrones de valencia: Número de electrones presentes en el último nivel.
Ejm:
14Si: 1s
a) Nivel de energía más externo: 3
b) Último subnivel que se forma: p
c) Electrones de valencia: 2 + 2 = 4
29Cu: 1s
a) Nivel de energía más externo: 4
b) Último subnivel que se forma: d
c) Electrones de valencia: 2
Es importante observar que el nivel de energía mas externo, no corresponde necesariamente al último subnivel.
EJERCICIOS: Escriba la configuración electrónica condensada de los siguientes elementos indicando en cada caso:
a) Nivel de energía más externo
b) Electrones de valencia
c) Último subnivel que se forma
1.- 11Nab) Electrones de valencia
c) Último subnivel que se forma
2.- 60Nd
3.- 25Mn
4.-51Sb
b) DESARROLLADA.- En este tipo de configuración se muestran los cuatro números cuánticos: n, l, m y s.
El número cuántico por spin ( s ) se representa con flechas, una hacia arriba, otra hacia abajo, si están juntas en el mismo orbital:
El realizar la configuración electrónica desarrollada sigue ciertas reglas tales como:
PRINCIPIO DE MÁXIMA MULTIPLICIDAD O REGLA DE HUND.-
"Los orbitales con igual contenido de energía se van formando con un solo electrón antes de que formen pares". |
PRINCIPIO DE EDIFICACIÓN PROGRESIVA.-
"Dos electrones de un mismo átomo no pueden tener idénticos los cuatro números cuánticos, al menos uno es diferente". |
ESTRUCTURAS DEL ÁTOMO
Protón, descubierto por Ernest Rutherford a principios del siglo XX, el protón es una partícula elemental que constituye parte del núcleo de cualquier átomo. El número de protones en el núcleo atómico, denominado número atómico, es el que determina las propiedades químicas del átomo en cuestión. Los protones poseen carga eléctrica positiva y una masa 1.836 veces mayor de la de los electrones.
Neutrón, partícula elemental que constituye parte del núcleo de los átomos. Fueron descubiertos en 1930 por dos físicos alemanes,Walter Bothe y Herbert Becker. La masa del neutrón es ligeramente superior a la del protón, pero el número de neutrones en el núcleo no determina las propiedades químicas del átomo, aunque sí su estabilidad frente a posibles procesos nucleares (fisión, fusión o emisión de radiactividad). Los neutrones carecen de carga eléctrica, y son inestables cuando se hallan fuera del núcleo, desintegrándose para dar un protón, un electrón y un antineutrino.
Electrón, partícula elemental que constituye parte de cualquier átomo, descubierta en 1897 por J. J. Thomson. Los electrones de un átomo giran en torno a su núcleo, formando la denominada corteza electrónica. La masa del electrón es 1836 veces menor que la del protón y tiene carga opuesta, es decir, negativa. En condiciones normales un átomo tiene el mismo número de protones que electrones, lo que convierte a los átomos en entidades eléctricamente neutras. Si un átomo capta o pierde electrones, se convierte en un ion.
Molecula
Una molécula es la cantidad más pequeña que puede existir de una sustancia. Está contituida por átomos que son diferentes entre sí y por esta razón, se pueden separar cada uno de ellos. Sin embargo, dichos átomos no se pueden separar más sin provocar una reacción nuclear.
Las moléculas pueden tener propiedades muy diferentes de las que tienen los elementos que la componen. Por ejemplo: el agua se comporta de manera muy diferente a como se comporta individualmente el oxígeno y el hidrógeno.
IONES
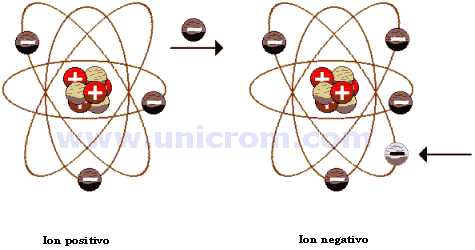
es una partícula cargada eléctricamente constituida por un átomo o molécula que no es eléctricamente neutral. Conceptualmente esto se puede entender como que, a partir de un estado neutro de un átomo o partícula, se han ganado o perdido electrones; este fenómeno se conoce como ionización.
Los iones cargados negativamente, producidos por haber más electrones que protones, se conocen como aniones (que son atraídos por el ánodo) y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes (los que son atraídos por el cátodo).
- Anión ("el que va hacia arriba") tiene carga eléctrica negativa.
- Catión ("el que va hacia abajo") tiene carga eléctrica positiva.
Ánodo y cátodo utilizan el sufijo '-odo', del griego odos (-οδος), que significa camino o vía.
- Ánodo: ("camino ascendente de la corriente eléctrica") polo positivo".2
- Cátodo: ("camino descendente de la corriente eléctrica") polo negativo".
Un ion conformado por un solo átomo se denomina ion monoatómico, a diferencia de uno conformado por dos o más átomos, que se denomina ion poliatómico.
La masa atómica o numero másico
La masa atómica es la cantidad de materia que tiene un átomo y generalmente se obtiene de sumar Z + N = A
Z= el numero de protones
N= el numero de neutrones
A= masa atómica
El numero atómico:
El numero atómico es el numero entero positivo que equivale al numero total de protones en un núcleo del átomo. Se suele representar con la letra Z. Es característico de cada elemento químico y representa una propiedad fundamental del átomo.
Este hecho permitió clasificar a los elementos en la tabla periódica en orden creciente de numero atómico.
CONFIGURACIÓN ELECTRÓNICA
En física y química, la configuración electrónica indica la manera en la cual los electrones se estructuran o se modifican en un átomo de acuerdo con el modelo de capas electrónicas, en el cuál las funciones de ondas del sistema se expresa como un producto de orbitales antisimetrizadas.1 2 La configuración electrónica es importante porque determina las propiedades de combinación química de los átomos y por tanto su posición en la tabla periódica.Notación[editar]
Se utiliza en una notación estándar para describir las configuraciones electrónicas de átomos y moléculas. Para los átomos, la notación contiene la definición de los orbitales atómicos (en la forma n l, por ejemplo 1s, 2p, 3d, 4f) indicando el número de electrones asignado a cada orbital (o al conjunto de orbitales de la misma subcapa) como un superíndice. Por ejemplo, el hidrógeno tiene un electrón en el orbital s de la primera capa, de ahí que su configuración electrónica se escriba 1s1. El litio tiene dos electrones en la subcapa 1s y uno en la subcapa 2s (de mayor energía), de ahí que su configuración electrónica se escriba 1s2 2s1 (pronunciándose "uno-ese-dos, dos-ese-uno"). Para el fósforo (número atómico 15), tenemos: 1s2 2s2 2p6 3s2 3p3.
Para átomos con muchos electrones, esta notación puede ser muy larga por lo que se utiliza una notación abreviada, que tiene en cuenta que las primeras subcapas son iguales a las de algún gas noble. Por ejemplo, el fósforo, difiere del argón y neón (1s2 2s2 2p6) únicamente por la presencia de la tercera capa. Así, la configuración electrónica del fósforo se puede escribir respecto de la del neón como: [Ne] 3s2 3p3. Esta notación es útil si tenemos en cuenta que la mayor parte de las propiedades químicas de los elementos vienen determinadas por las capas más externas.
El orden en el que se escriben los orbitales viene dado por la estabilidad relativa de los orbitales, escribiéndose primero aquellos que tienen menor energía orbital. Esto significa que, aunque sigue unas pautas generales, se pueden producir excepciones. La mayor parte de los átomos siguen el orden dado por la regla de Madelung. Así, de acuerdo con esta regla, la configuración electrónica del hierro se escribe como: [Ar] 4s2 3d6. Otra posible notación agrupa primero los orbitales con el mismo número cuántico n, de tal manera que la configuración del hierro se expresa como [Ar] 3d6 4s2 (agrupando el orbital 3d con los 3s y 3p que están implícitos en la configuración del argón).
El superíndice 1 de los orbitales ocupados por un único electrón no es obligatorio.4 Es bastante común ver las letras de los orbitales escritas en letra itálica o cursiva. Sin embargo, la Unión Internacional de Química Pura y Aplicada (IUPAC) recomienda utilizar letra normal, tal y como se realiza aquí.
Origen histórico
Niels Bohr fue el primero en proponer (1923) que la periodicidad en las propiedades de los elementos se podía explicar mediante la estructura electrónica del átomo.5 Su propuesta se basó en el modelo atómico de Bohr para el átomo, en el cual las capas electrónicas eran órbitas electrónicas a distancias fijas al núcleo. Las configuraciones originales de Bohr hoy parecen extrañas para el químico: al azufre se le asignaba una configuración 2.4.4.6 en vez de 1s2 2s2 2p6 3s2 3p4.
Un año después, E. C. Stoner incorpora el tercer número cuántico de la teoría de Sommerfeld en la descripción de las capas electrónicas, y predice correctamente la estructura de capas del azufre como 2.8.6.6 Sin embargo, ni el sistema de Bohr ni el de Stoner podían describir correctamente los cambios del espectro atómico en un campo magnético (efecto Zeeman). [1]
Distribución electrónica
Para comprender el diagrama de Moeller se utiliza la siguiente tabla:Es la distribución de los electrones en los subniveles y orbitales de un átomo. La configuración electrónica de los elementos se rige según el diagrama de Moeller:
| s | p | d | f | |
|---|---|---|---|---|
Para encontrar la distribución electrónica se escriben las notaciones en forma diagonal desde arriba hacia abajo y de derecha a izquierda (seguir colores):
Este principio de construcción (denominado principio de Aufbau, del alemán Aufbau que significa 'construcción') fue una parte importante del concepto original de Bohr de configuración electrónica. Puede formularse como:7
- sólo se pueden ocupar los orbitales con un máximo de dos electrones, en orden creciente de energía orbital: los orbitales de menor energía se llenan antes que los de mayor energía.
Así, vemos que se puede utilizar el orden de energías de los orbitales para describir la estructura electrónica de los átomos de los elementos. Un subnivel s se puede llenar con 1 o 2 electrones. El subnivel p puede contener de 1 a 6 electrones; el subnivel d de 1 a 10 electrones y el subnivel f de 1 a 14 electrones. Ahora es posible describir la estructura electrónica de los átomos estableciendo el subnivel o distribución orbital de los electrones. Los electrones se colocan primero en los subniveles de menor energía y cuando estos están completamente ocupados, se usa el siguiente subnivel de energía superior. Esto puede representarse por la siguiente tabla:
| s | p | d | f | |
|---|---|---|---|---|
Para encontrar la configuración electrónica se usa el mismo procedimiento anterior incluyendo esta vez el número máximo de electrones para cada orbital.
Finalmente la configuración queda de la siguiente manera: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Para determinar la configuración electrónica de un elemento, basta con calcular cuántos electrones hay que acomodar y entonces distribuirlos en los subniveles empezando por los de menor energía e ir llenando hasta que todos los electrones estén distribuidos. Un elemento con número atómico mayor tiene un electrón más que el elemento que lo precede. El subnivel de energía aumenta de esta manera:
- Subnivel s, p, d o f: Aumenta el nivel de energía.
Sin embargo, existen excepciones, como ocurre en los elementos de transición al ubicarnos en los grupos del cromo y del cobre, en los que se promueve el electrón dando así una configuración fuera de lo común.
Tipos de configuración electrónica
Para graficar la configuración electrónica existen cuatro modalidades, con mayor o menor complejidad de comprensión, que son:
Configuración estándar
Se representa la configuración electrónica que se obtiene usando elcuadro de las diagonales (una de sus formas gráficas se muestra en la imagen de la derecha).
Es importante recordar que los orbitales se van llenando en el orden en que aparecen, siguiendo esas diagonales, empezando siempre por el 1s.
Aplicando el mencionado cuadro de las diagonales la configuración electrónica estándar, para cualquier átomo, es la siguiente:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Más adelante explicaremos cómo se llega este enjambre de números y letras que perturba inicialmente, pero que es de una simpleza sorprendente.
Configuración condensada
Los niveles que aparecen llenos en la configuración estándar se pueden representar con un gas noble (elemento del grupo VIII A,Tabla Periódica de los elementos), donde el número atómico del gas coincida con el número de electrones que llenaron el último nivel.
Los gases nobles son He, Ne, Ar, Kr, Xe y Rn.
Configuración desarrollada
Consiste en representar todos los electrones de un átomo empleando flechas para simbolizar el spin de cada uno. El llenado se realiza respetando el principio de exclusión de Pauli y la Regla de máxima multiplicidad de Hund.
Configuración semidesarrollada
Esta representación es una combinación entre la configuración condensada y la configuración desarrollada. En ella sólo se representan los electrones del último nivel de energía.
Tabla periódica de los elementos
La tabla periódica de los elementos clasifica, organiza y distribuye los distintos elementos químicos conforme a sus propiedades y características; su función principal es establecer un orden específico agrupando elementos.
Suele atribuirse la tabla a Dmitri Mendeléyev, quien ordenó los elementos basándose en sus propiedades químicas,1 si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos.2 La estructura actual fue diseñada por Alfred Werner a partir de la versión de Mendeléyev. En 1952, el científico costarricense Gil Chaverri (1921-2005) presentó una nueva versión basada en la estructura electrónica de los elementos, la cual permite ubicar las series lantánidos y los actínidos en una secuencia lógica de acuerdo con su número atómico.3
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A | |
| Periodo | ||||||||||||||||||
| 1 | 1 H | 2 He | ||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr |
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe |
| 6 | 55 Cs | 56 Ba | ✶ | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn |
| 7 | 87 Fr | 88 Ra | ◘ | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Fl | 115 Uup | 116 Lv | 117 Uus | 118 Uuo |
| ✶ | Lantánidos | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | |
| ◘ | Actínidos | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr |
| Alcalinos | Alcalinotérreos | Lantánidos | Actínidos | Metales de transición |
| Metales del bloque p | Metaloides | No metales | Halógenos | Gases nobles y Transactínidos |
CLASIFICACIÓN DE LOS ELEMENTOS LAVOISIER
METALES
Propiedades Físicas
Las propiedades físicas de los metales son aquellas que logran cambiar la materia sin alterar su
composición; como ocurre cuando moldeas un trozo de plastilina, sus átomos no se ven alterados de
ninguna manera, pero exteriormente cambia su forma.
Los metales suelen ser duros y resistentes. Aunque existen ciertas variaciones de uno a otro, en
general las principales propiedades de los metales son: dureza o resistencia a ser rayados; resistencia
longitudinal o resistencia a la rotura; elasticidad o capacidad de volver a su forma original después de
sufrir deformación; maleabilidad o posibilidad de cambiar de forma por la acción del martillo; resistencia
a la fatiga o capacidad de soportar una fuerza o presión continuadas y ductilidad o posibilidad de
deformarse sin sufrir roturas.
Propiedades Químicas
Las propiedades químicas de los metales son aquellas propiedades que se hace evidente durante
una reacción química (que existe un cambio); es decir, cualquier cualidad que puede ser establecida
solamente al cambiar la identidad química de una sustancia.
Los átomos de los métales tienen 1, 2 o 3 electrones en su último nivel de energía. Los elementos
que forman los grupos IA, IIA, IIIA son metálicos, por lo tanto los elementos del grupo IA tienen en su
último nivel de energía un electrón, los del grupo IIA tienen dos electrones y los del IIIA tienen tres
electrones. Sus átomos pueden perder los electrones de su último nivel de energía y, al quedar con más
cargas positivas forman iones positivos llamados cationes. Sus moléculas son mono atómicas; es decir, sus
moléculas están formadas por un solo átomo (Al, Cu, Ca, Mg, Au).
Podemos distinguir las siguientes propiedades fisicoquímicas de los metales:
• Peso específico.
• Punto de fusión.
• Calor específico.
• Calor latente de fusión.
• Dilatación y contracción.
• Extensión.
• Impenetrabilidad.
• Divisibilidad.
• Inercia.
• Resistencia a la oxidación .
• Resistencia a la corrosión.
• Aleabilidad.
• Pesantez.
• Fluencia.
• Magnetismo.
• Conductividad eléctrica.
• Conductividad térmica.
No metales:
Junto con los metales y los metaloides (o semimetales), los no metales comprenden una de las tres categorías de elementos químicos siguiendo una clasificación de acuerdo con las propiedades de enlace e ionización. Se caracterizan por presentar una alta electronegatividad, por lo que es más fácil que ganen electrones a que los pierdan.
Los no metales, excepto el hidrógeno, están situados en la tabla periódica de los elementos en el bloque p. De este bloque, excepto los metaloides y, generalmente, gases nobles, se considera que todos son no metales.
En orden de número atómico:
• Hidrógeno (H)
• Carbono (C)
• Nitrógeno (N)
• Oxígeno (O)
• Flúor (F)
• Fósforo (P)
• Azufre (S)
• Cloro (Cl)
• Selenio (Se)
• Bromo (Br)
• Yodo (I)
• Ástato (At)
El hidrógeno normalmente se sitúa encima de los metales alcalinos, pero normalmente se comporta como un no metal. Un no metal suele ser aislante o semiconductor de la electricidad. Los no metales suelen formar enlaces iónicos con los metales, ganando electrones, o enlaces covalentes con otros no metales, compartiendo electrones. Sus óxidos son ácidos.
Los no metales forman la mayor parte de la tierra, especialmente las capas más externas, y los organismos están compuestos en su mayor parte por no metales. Algunos no metales, en condiciones normales, son diatómicos en el estado elemental: hidrógeno (H2), nitrógeno (N2), oxígeno (O2), flúor (F2), cloro (Cl2), bromo (Br2) y yodo (I2).
• No tienen ilustre; diversos colores.
• Los sólidos suelen ser quebradizos; algunos duros y otros blandos.
• Malos conductores del calor y la electricidad al compararlos con los metales.
• La mayor parte de los óxidos no metálicos son sustancias moleculares que forman soluciones ácidas
• Tienden a formar aniones (iones negativos) u oxianiones en solución acuosa.
• Usualmente son menos densos que los metales.
• No brillan
METALOIDES
Junto con los Metales y los No metales, los Metaloides comprenden una de las tres categorías de elementos químicos siguiendo una clasificación de acuerdo con las propiedades de enlace e ionización. Sus propiedades son intermedias entre los metales y los no metales. No hay una forma unívoca de distinguir los metaloides de los metales verdaderos, pero generalmente se diferencian en que los metaloides son semiconductores antes que conductores.
Son considerados metaloides los siguientes elementos:
• Boro (B)
• Silicio (Si)
• Germanio (Ge)
• Arsénico (As)
• Antimonio (Sb)
• Telurio (Te)
• Polonio (Po)
Dentro de la tabla periódica los metaloides se encuentran en línea diagonal desde el boro al trilodita. Los elementos que se encuentran encima a la derecha son no metales, y los que se encuentran debajo a la izquierda son metales.
Son elementos que poseen, generalmente, cuatro electrones en su última órbita. El silicio (Si), por ejemplo, es un metaloide ampliamente utilizado en la fabricación de elementos semiconductores para la industria electrónica, como rectificadores diodos, transistores, circuitos integrados, microprocesadores, etc.
ENLACES QUÍMICOS
Un enlace químico es el proceso químico responsable de las interacciones entre átomos, moléculas e iones, que tiene una estabilidad en los compuestos diatómicos y poliatómicos. Es uno de los conceptos químicos más difíciles de explicar; es por eso que se aborda a través de diversas teorías.
Los químicos suelen apoyarse en la fisicoquímica o en descripciones cualitativas.
En general, el enlace químico fuerte está asociado en la transferencia de electrones entre los átomos participantes. Las moléculas, cristales, y gases diatómicos —que forman la mayor parte del ambiente físico que nos rodea— está unido por enlaces químicos, que determinan las propiedades físicas y químicas de la materia.
Las cargas opuestas se atraen, porque, al estar unidas, adquieren una situación más estable que cuando estaban separados. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles ya que los electrones que orbitan el núcleo están cargados negativamente, y que los protones en el núcleo lo están positivamente, la configuración más estable del núcleo y los electrones es una en la que los electrones pasan la mayor parte del tiempo entre los núcleos, que en otro lugar del espacio. Estos electrones hacen que los núcleos se atraigan mutuamente.
ENLACES COVALENTES
El enlace covalente polar es intermediado en su carácter entre un enlace covalente y un enlace iónico. Los enlaces covalentes polares se forman con átomos distintos con gran diferencia de electronegatividades. La molécula es eléctricamente neutra, pero no existe simetría entre las cargas eléctricas originando la polaridad, un extremo se caracteriza por ser electropositivo y el otro electronegativo.
Los enlaces covalentes pueden ser simples cuando se comparte un solo par de electrones, dobles al compartir dos pares de electrones, triples cuando comparten tres pares de electrones, o cuádruples cuando comparten cuatro pares de electrones.
Los enlaces covalentes no polares(0 o menor que 0,04) se forman entre átomos iguales, no hay variación en el número de oxidación. Los átomos enlazados de esta forma tienen carga eléctrica neutra.
En otras palabras, el enlace covalente es la unión entre átomos en donde se da un compartimiento de electrones, los átomos que forman este tipo de enlace son de carácter no metálico. Las moléculas que se forman con átomos iguales (mononucleares) presentan un enlace covalente pero en donde la diferencia de electronegatividades es nula.
Se presenta entre los elementos con poca diferencia de electronegatividad (< 1.7), es decir cercanos en la tabla periódica de los elementos químicos o bien, entre el mismo elemento para formar moléculas diatómicas.
ENLACES IONICOS
El enlace iónico es un tipo de interacción electrostática entre átomos que tienen una gran diferencia de electronegatividad. No hay un valor preciso que distinga la ionicidad a partir de la diferencia de electronegatividad, pero una diferencia sobre 2.0 suele ser iónica, y una diferencia menor a 1.7 suele ser covalente. En palabras más sencillas, un enlace iónico es aquel en el que los elementos involucrados aceptan o pierden electrones (se da entre un catión y un anión) o dicho de otra forma, aquel en el que un elemento más electronegativo atrae a los electrones de otro menos electronegativo.3 El enlace iónico implica la separación en iones positivos y negativos. Las cargas iónicas suelen estar entre -3e a +3e.
1) Se presenta entre los elementos con gran diferencia de electronegatividad (>1.7), es decir alejados de la tabla periódica: entre metales y no metales. 2) Los compuestos que se forman son sólidos cristalinos con puntos de fusión elevados. 3) Se da por TRANSFERENCIA de electrones: un átomo PIERDE y el otro 'GANA'. 4) Se forman iones (cationes con carga positiva y aniones con carga negativa).


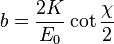
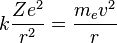




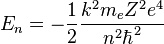

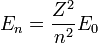
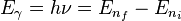






No hay comentarios:
Publicar un comentario